Biografía de Amedeo Avogadro | Científicos famosos.

Observación: Esta traducción se proporciona con fines educativos y puede contener errores o ser imprecisa.
Vivió 1776 – 1856.
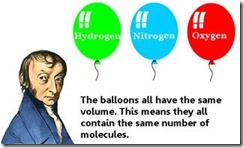
Amedeo Avogadro es mejor conocido por su hipótesis de que volúmenes iguales de gases diferentes contienen igual número de moléculas, siempre que sean a la misma temperatura y presión.
Su hipótesis fue rechazada por otros científicos. Sólo ganó aceptación después de su muerte. Ahora se llama ley de Avogadro.
También fue el primer científico para darse cuenta que existan elementos en forma de moléculas en lugar de átomos individuales.
Vida de Avogadro
Amedeo Avogadro nació en Turín, Italia, el 09 de agosto de 1776.Su fondo de familia era aristocrática. Su padre, Filippo, fue un magistrado y un senador que tenía el título de Conde. Su madre era una mujer noble, Anna Vercellone de Biella.
Amedeo Avogadro heredó el título de Conde de su padre. De hecho, el nombre completo de Amedeo Avogadro fue Conde Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto – un bocado!
Avogadro era muy inteligente. En 1796, cuando tenía sólo 20, obtuvo un doctorado en derecho canónico y comenzó a practicar como abogado eclesiástico.
Aunque había seguido la tradición familiar al estudiar derecho, poco a poco perdió interés en asuntos legales. Ciencia encontró mucho más intelectualmente estimulante.
Matemáticas y física en particular atrajo su mente lógica. Él pasó cantidades crecientes de tiempo estudiando a estos temas. En esto fue ayudado por el físico matemático prominente profesor Vassalli Eandi.
En 1803, en colaboración con su hermano Felice, Avogadro publicó su primer artículo científico, que vieron el comportamiento eléctrico de soluciones salinas. Esta era la ciencia de vanguardia: sólo tres años antes, científico italiano compañero de Avogadro Alessandro Volta demostró la pila eléctrica por primera vez.
En 1806, envejecido 30, Avogadro abandonó su práctica legal acertada y empezó a enseñar matemáticas y física en la escuela secundaria en Turín. En 1809 se convirtió en un profesor en la Universidad de Vercelli.
En 1820, Avogadro se convirtió en profesor de física matemática en la Universidad de Turín. Por desgracia, este post fue corto debido a la agitación política. Avogadro perdió su trabajo en 1823.
Avogadro fue reelegido en 1833 y permaneció en este puesto hasta que, a la edad de 74, se jubiló en el año 1850.
Aunque él era un aristócrata, Avogadro fue un hombre de pies en la tierra, privado, que era silencio religioso. Se dedicaba al trabajo duro y su estilo de vida era simple. El nombre de su esposa fue Felicita Mazzé. Casó en 1818 cuando Avogadro era 42 años de edad. Ellos tuvieron seis hijos.
Contribuciones de Avogadro a la ciencia
En el 1800s temprano, ideas de los científicos sobre las partículas que hoy conocemos como átomos y moléculas eran muy limitadas y a menudo incorrecto. Avogadro estaba profundamente interesado en averiguar cómo las partículas básicas de la materia se comportaban y se unieron para formar compuestos químicos.Estudió la obra de otros dos científicos:
1. John Dalton
En 1808, John Dalton publicó su teoría atómica propone que toda la materia está hecha de átomos. Él indicó que todos los átomos de un elemento son idénticos, y los átomos de elementos diferentes tienen masas diferentes. De esta manera, Dalton llevó a química a un nuevo nivel. Pero también cometió errores sobre los elementos de forma se combinan para forma compuestos. Por ejemplo, pensaba agua fue hecha de un átomo de hidrógeno y un átomo de oxígeno y escribió como HO; Hoy sabemos que el agua contiene dos hidrógenos a cada oxígeno y escribimos agua como H20. En realidad, Avogadro figuraba esto, como veremos.2. Joseph Gay-Lussac
En 1809 Joseph Gay-Lussac publicó su ley de combinación de volúmenes de gas. Él había notado que cuando dos litros de hidrógeno reaccionan con un litro de gas oxígeno, forman dos litros de agua gaseosa. Todos los gases que él reaccionó parecían reaccionar en proporciones de volumen simple.Hipótesis de Avogadro
En 1811 Avogadro publicó un artículo en el Journal de Physique, el diario francés de física. Él dice que la mejor explicación para las observaciones de Gay-Lussac de reacciones gas que volúmenes iguales de todos los gases a la misma temperatura y presión contienen igual número de moléculas. Esto ahora se llama ley de Avogadro. Publicó cuando él trabajaba como profesor de física en la Universidad de Vercelli.En la vista (correcto) de Avogadro, la razón por la que dos litros de hidrógeno reaccionan con un litro de oxigeno gaseoso para formar sólo dos litros de agua gaseosa es que disminuye el volumen porque el número de partículas presentes disminuye. Por lo tanto debe ser la reacción química:
2H2 (gas) + O2 (gas) → 2 H20 (gas)
En esta reacción tres partículas (dos moléculas de hidrógeno y oxígeno de una molécula) vienen juntos para formar dos partículas de agua... o 200 partículas reaccionan con 100 partículas para formar 200 partículas... o 2 millones de partículas reaccionan con partículas de 1 millón para formar partículas 2 millones... etc. El efecto observable es que después de la reacción, cuando todos los gases hidrógeno y oxígeno se han convertido en gas de H20, el volumen de gas cae a dos tercios del volumen inicial.
Como resultado de estas observaciones Avogadro se convirtió en el primer científico para darse cuenta que podrían existir elementos como las moléculas en lugar de átomos individuales. Por ejemplo, reconoció que el oxígeno alrededor de nosotros existe como una molécula en la cual están vinculados dos átomos de oxígeno.
Otros científicos en el campo, como Dalton, creen que sólo los compuestos podrían formar moléculas mientras que existieron todos los elementos como átomos individuales.

Avogadro se dio cuenta que elementos podrían existir en forma de moléculas con átomos individuales que se unieron.
En 1815 Avogadro publicó un documento adicional en el Journal de Physique discutiendo las masas de los átomos, sus compuestos y sus densidades del gas.
En 1821, ahora de la escritura como el profesor de física matemática en la Universidad de Turín, él publicó un papel más en las masas de los átomos y las proporciones en que se combinan.
Entre 1837 y 1841 Avogadro publicó cuatro volúmenes pesados en detalle en la física de la materia.
Los resultados de Avogadro fueron ignorados casi por completo hasta que Stanislao Cannizarro presentó en la Conferencia de Karlsruhe en 1860, cuatro años después de la muerte de Avogadro. Esta Conferencia había sido llamada para remediar la confusión científica que existió sobre átomos, moléculas y sus masas.
Incluso después de Cannizarro presentó su trabajo que no todos los científicos de acuerdo con él. Otra década pasó con defensa fuerte continuado de Cannizarro – antes de hipótesis de Avogardo llegó más ampliamente aceptado y se convirtió en ley de Avogadro.
Avogadro se mira hoy como uno de los fundadores de la química atómica y molecular.
¿Por qué se ha rechazado la hipótesis de Avogadro durante décadas?
Hay un número de razones por qué trabajo de Avogadro no fue aceptada rápidamente:• Publicó su trabajo en el Journal de Physique, que no era una revista muy bien leer.
• Las teorías de los científicos más conocidos de la época, como John Dalton y Jöns Jacob Berzelius, en desacuerdo con el trabajo de Avogadro.
• Italia – el país de Leonardo da Vinci y Galileo – ya no era considerado como un país donde se realizó la gran ciencia. Darse cuenta de esto, unos años antes, su compatriota de Avogadro Alessandro Volta había viajado fuera de Italia sí mismo y su obra conoce a los científicos en otros países. Avogadro se quedó en Italia y no hizo contacto con científicos extranjeros para ayudar a cerrar la brecha como Volta había hecho.
Aunque nos gusta pensar de la ciencia como un esfuerzo noble, donde la verdad se convertirá rápidamente en obvia, esto no es siempre el caso. Los científicos son simplemente personas; pueden ser tercos, así como todos podemos ser a veces. Si usted tiene una teoría científica nueva polémica y no son bien conocidos, parece que contacto personal a veces puede alcanzar tanto como un artículo científico, o incluso más.
Constante de Avogadro
Constante de Avogadro es uno de los números más importantes en química. Su valor es de 6.02214129 x 1023. Avogadro no calcular este número, pero su existencia sigue lógicamente de su hipótesis y el trabajo.Constante de Avogadro es el número de partículas (átomos o moléculas) en un mol de cualquier sustancia. Por ejemplo, 12 gramos de carbono contienen 6.02214129 x 1023 átomos de carbono.
Constante de Avogadro es un número enorme. Si usted podría ahorrar 1 millón de dólares al segundo, le tomaría más tiempo que el universo se cree que han existido para salvar a 6.02214129 x 1023 dólares; que va a demostrar que tiene un montón de átomos para hacer una pequeña cantidad de materia!
"Mis estudios de las ciencias naturales han implicado sobre todo esa parte de la física que se ve en el mundo atómico: las propiedades de las moléculas, las fuerzas implicadas en el movimiento, la capacidad calorífica de diferentes sustancias, expansión de gases por el calor y la densidad y la presión de los gases."
Amedeo Avogadro, 1776 – 1856